Главная > Статьи > Страница 14
Многие компании и продукты XX века выглядели настолько незыблемо на рынке, что невозможно было представить их отсутствие в недалеком будущем. Однако, инновации способны оставить любой бизнес в прошлом, если он не сможет приспособится к современным реалиям, новым технологиям работы, потребности клиента в новых продуктах и их свойствах.
В химии воды показатели рН*, общей жесткости**, щелочности*** и количества углекислоты**** контролируют все процессы коррозии и накипеобразование.
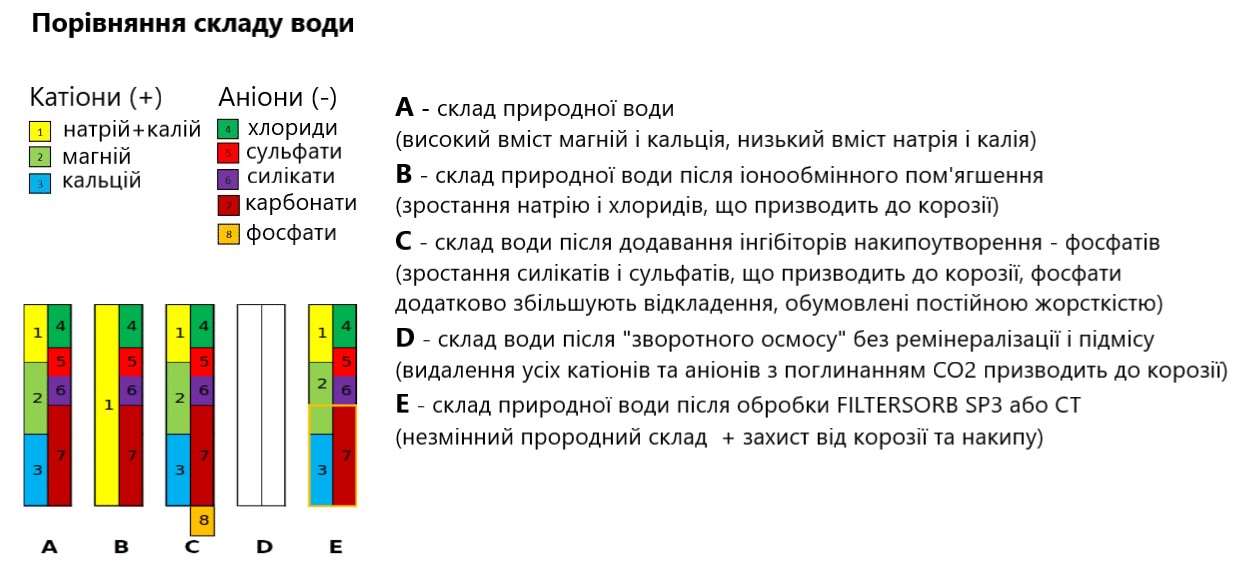
Рисунок 1. Технологии контроля накипеобразования. Изменение состава воды.
Технологии, которые на сегодняшний день применяют в водоподготовке для контроля накипеобразования в коммунальном и бытовом секторе:
- Фосфаты ( полифосфаты). Секвестирование солей карбонатной жесткости.
Фосфаты впервые были применены в водоподготовке в далеком 1887 году. В 30-х годах XX века дозирование фосфатов в воду получило широкое применение дозирование в воду 2 мг/л порошка гексаметафосфата натрия для контроля карбонатных отложений в трубопроводах. В 70-х годах распространение получила технология дозирование фосфата цинка в воду с низкой жесткостью для снижения ее коррозионной активности.
Фосфаты теряют еффективность при общей жесткости больше 3 мг-экв/л. Дозирование фосфатов приводит к росту общей минерализации и рН, что способствует размножению бактерий в водопроводной системе. Дозирование должно осуществляться автоматически или вручную контролируемо с сохранением пропорции 2 мг/л. Вода с общей жесткостью больше 3 мг-экв/л требовала применения других технологий – ионного обмена или обратного осмоса.
Как итог, дозирование фосфатов увеличивает общую минерализацию, повышает рН, снижает содержание CO2, не эффективно при общей жесткости больше 3 мг-экв/л, препятствует отложению карбонатной накипи, увеличивает отложения солей постоянной жесткости (фосфаты увеличивают постоянную жесткость). Технология позволяет устранить проблему отложений карбонатной жесткости, однако дозирование фосфатов увеличивает отложения постоянной жесткости.
- Ионный обмен. Умягчение.
Ионный обмен для умягчения воды впервые был применен в 1903 году. Технология позволяет физически «обменять» кальций и магний, заменив их на эквивалентное количество ионов натрия. Технология меняет состав воды: в воде вместо гидрокарбонатов кальция и магния появляется гидрокарбонат натрия (NaHCO3, пищевая сода), каждый 1 мг которого способен освободить 0,79 мг CO2. Свободная углекислота, увеличивает концентрацию ионов водорода (Н+), снижает рН и снижает щелочность. Не меняя эквивалентные концентрации ионов в воде процесс ионообменного умягчения увеличивает общую минерализацию воды за счет разного эквивалентного веса (каждые 20 мг кальция или 12 мг магния обмениваются на 23 мг натрия). Изменение солевого состава оказывает прямое влияние на вкус воды. Технология требует применения реагентов (таблетированной соли), громоздких корпусов и микропроцессорного клапана управления, оказывает влияние на окружающую среду (при регенерации сброс в канализацию хлоридов кальция и магния, повышающих соленость природных источников пресной воды).
В результате умягчения воды «ионым обменом» снижается рН, увеличивается количество свободной углекислоты, снижается щелочность, кардинально меняется химический состав солей и увеличивается общая минерализация. Технология ионообменного умягчения позволяет устранить проблему отложений карбонатной жесткости, но повышает коррозионную активность воды.
- Обратный осмос. Деминерализация.
Процесс не отличается скоростью. Каждый литр деминерализованной воды требует сброса в канализацию минимум 2…3 литров технологической воды с концентрирванным примесями. Все трубопроводы и запорная арматура должны быть выполнены из пластика, так как полностью деминерализованная вода обладает кислой реакцией (контакт с атмосферным CO2) и, соответственно, высокой коррозионной активностью. Для нормального использования такой воды необходима повторная минерализация. Общая жесткость более 2,5 мг-екв/л существенно сокращает срок службы мембраны.
- Каталитическая кристаллизация солей жесткости (NAC-технология).
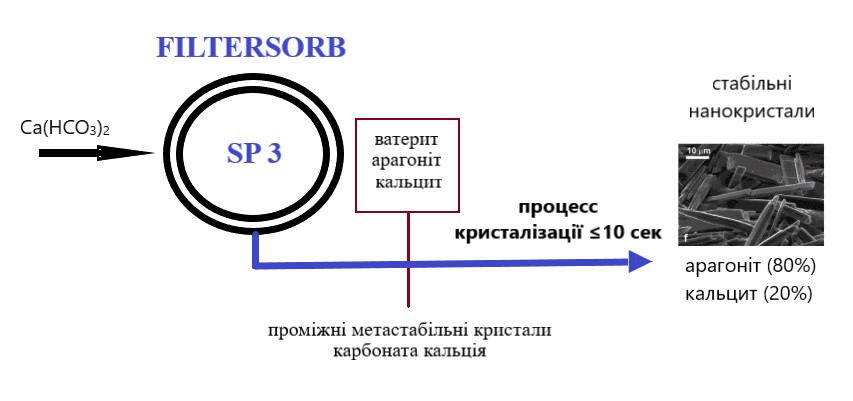
FILTERSORB SP (Scale Prevention) 3 указывает на результат трансформации растворенных гидрокарбонатов кальция в три компонента: CaCO₃ (микрокристаллы арагонита), CO₂ (свободная углекислота в коллоидной форме) и H₂O (чистая вода).
Этап 1. Керамические шарики со специальным покрытием FILTERSORB SP3 активируют и контролируют процесс трансформации гидрокарбонатов кальция и магния в нераствимые наночастици кристаллов арагонита, которые не «прилипают» к поверхностям и находятся в коллоидном состоянии. На сегодняшний день FILTERSORB SP3 единственная доступная среда, вызывающая трансформацию такого рода.
Этап 2. В процессе движения через трубопроводы и бытовые приборы вода, обработанная FILTERSORB SP3, удаляет ранее отложенную карбонатную накипь.
Этап 3. После удаления накипных отложений FILTERSORB SP3 формирует на трубах, кольцевых уплотнениях и проточных компонентах оборудования гладкий защитный слой арагонита толщиной от 3 до 5 мкм, препятствующий коррозии.
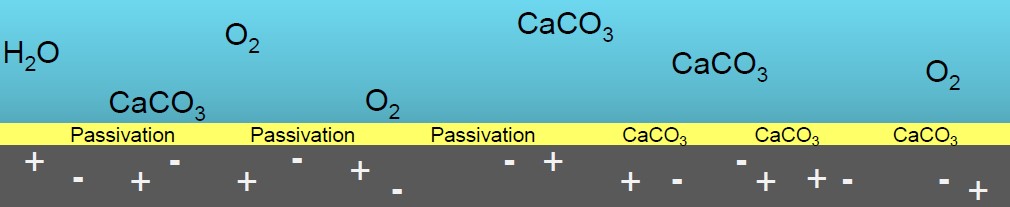 Общая минерализация и рН воды остаются неизменными. Примеси не удаляются. Коррозионная активность воды не увеличивается.
Общая минерализация и рН воды остаются неизменными. Примеси не удаляются. Коррозионная активность воды не увеличивается.
*Водородный показатель рН — мера кислотности и щелочности раствора.
**Общая жесткость характеризует количество растворенных в воде солей щелочноземельных металлов.
***Щелочность характеризует способность воды сопротивляться изменению рН.
****Углекислый газ находится в воде в связанной (карбонат-анионы CO32-), полусвязанной (гидрокарбонат-анионы HCO3—) и свободной (газообразный CO2 и угольная кислота H2CO3) формах. Углекислый газ непосредственно оказывает влияние на рН, представляя основной источник кислотности в воде. Чем больше углекислоты, тем ниже рН.
